Карбонизация портландита в условиях низкой влажности*
РЕФЕРАТ. Путем компьютерных исследований с использованием функциональной теории плотности (Density Functional Theory, DFT) изучены направления реакции карбонизации портландита. Выполнено также экспериментальное исследование карбонизации портландита в условиях низкой относительной влажности (40 %). В течение первых 74 ч карбонизации дважды наблюдался переход от кинетического режима процесса к диффузионному. Первый цикл чередования химического и диффузионного режимов обусловлен реакциями на поверхности, тогда как второй — реакциями в растворе. Таким образом, завершение диффузионной стадии в первом цикле соответствует переходу реакции от «поверхностного» механизма к «сквозьрастворному». Полученные результаты показывают, что даже в среде с низкой влажностью карбонизация может иметь место — сначала как реакция на поверхности, а затем как реакция в растворе. Это может иметь значение для разработки новых способов применения карбонизации при проектировании конструкционных материалов.
Ключевые слова: карбонизация, портландит, кинетика, диффузия.
Keywords: carbonization, portlandite, kinetics, diffusion.
1. Введение
Карбонизация — явление, широко известное в строительной химии. Тем не менее ее истинные химические механизмы еще не установлены полностью. Несмотря на многочисленные исследования кинетики карбонизации [1—5] существует пробел в исследованиях ее химизма. Среди множества экспериментальных работ число исследований, моделирующих химизм процесса, незначительно. Важными являются исследования [6, 7], в которых приведено термодинамическое описание поверхности оксида кальция, контактирующей с H2O и CO2, с учетом гидроксилирования поверхности СаО.
Компьютерные исследования указанной проблемы с использованием функциональной теории плотности (density functional theory, DFT) позволили изучить направления реакции, и некоторые новые результаты моделирования представлены в рамках этой статьи.
В дополнение к данным, полученным путем вычислений, приведены результаты экспериментов, показывающие, как развивается карбонизация в среде с низкой влажностью (40 %) при комнатной температуре. В отличие от исследований, известных из литературы, авторы исследуют карбонизацию на различных участках поверхности и сравнивают полученные результаты с расчетными данными.
2. Экспериментальная часть
2.1. Реактор карбонизации
Для лабораторных исследований карбонизации авторы использовали специально сконструированный реактор (рис. 1). Он может быть закрыт чехлом из плексигласа (см. рис. 1, б) объемом 14 л, чтобы предотвратить массообмен с окружающей средой. Это позволяет контролировать состав атмосферы в реакторе и обеспечить строго определенную среду карбонизации. Образцы размещаются на сетке 8 (см. рис. 1, б), под которой находится вентилятор, обеспечивающий равномерное распределение СО2 в атмосфере реактора. Сухой воздух и СО2 подаются через трубки. Регуляторы расхода газа 1—3 (см. рис. 1, а) обеспечивают строго определенное соотношение газов. Регулятор 1 контролирует поток СО2. Один датчик СО2 (AlphaSense NDIR-sensor Pyro-IRC-A1) находится на входе в реактор и контролирует количество CO2, попадающего в реактор. Датчик 7 такого же типа (см. рис.1, б) анализирует содержание CO2 в газе, выходящем из реактора. Таким образом, можно вычислить количество CO2, поглощенного образцом. Остальные два регулятора расхода газа 2 и 3 откалиброваны для регулирования влажности воздуха. Один из двух регуляторов направляет воздух непосредственно в реактор через трубку, другой подает воздух в промывную склянку 5, наполненную дистиллированной водой (см. рис. 1, а и в). Путем подачи воздуха через пористую перегородку в воду обеспечивается его максимальное насыщение парами воды. Количество воздуха, пропускаемого через этот регулятор расхода газа, зависит от требуемой относительной влажности. Обе воздушные трубки объединяются перед тем, как воздух поступает в реактор. В месте соединения воздухопроводов и реактора датчик (Vaisala HMP110) определяет относительную влажность. Этот датчик контролирует количество воздуха, проходящего через промывную склянку. Таким образом, в реакторе строго поддерживаются заданные концентрация СО2 и влажность.

Рис. 1. Реактор CO2: а — общий вид установки, б — чехол из плексигласа, в — промывная склянка. 1—3 — регуляторы расхода газа; 4 — компьютер, управляющий реактором; 5 — промывная склянка; 6 — корпус реактора; 7 — датчик CO2 для газа, выходящего из реактора; 8 — держатель образца
Для лучшего контроля среды, особенно в случае исследования крупных образцов, эта установка была немного изменена. Авторы добавили датчики СО2 и относительной влажности на выходе из аппарата (см. эскиз реактора, рис. 2). Это позволяет не только регулировать относительную влажность газовой смеси, поступающей в аппарат, но и контролировать условия эксперимента, если образцы высвободили или связали значительные количества воды или СО2. Без дополнительных датчиков было бы невозможно зафиксировать указанные факторы и соответствующим образом отрегулировать газовую смесь для поддержания заданной среды внутри реактора. Таким образом, реактор позволяет оптимальным образом контролировать условия, в которых исследуется карбонизация.

Рис. 2. Эскиз реактора карбонизации. Установка обеспечивает оптимальный контроль среды в реакторе
Эксперименты по карбонизации выполнены при относительной влажности 40 % и содержании СО2, равном 30 %. Для экспериментов использованы порошок Ca(OH)2 и монокристаллы портландита. Порошок квалификации «чистый для анализа» с содержанием карбоната 0,64 %, которое определено с использованием анализа по Ритвельду, поставлен фирмой Merck. Монокристаллы выращивали по методике, описанной в работе [5]. Минеральные фазы были определены рентгено-дифракционным методом (Bruker D4 Endeavor, 40 kV, 30 mA, Cu Kα) и количественно уточнены методом Ритвельда. Электронно-микроскопическое исследование монокристаллов проведено на приборе FEI Quanta 250 FEG в условиях низкого вакуума, чтобы избежать накопления заряда в непроводящих образцах.
2.2. Исходные данные для расчетов
В качестве реагентов рассмотрены и одиночная молекула СО2, и кластер из молекулы СО2 и четырех молекул воды. Это позволяет исследовать влияние воды и в то же время обеспечивает ее минимальное количество, необходимое для образования угольной кислоты [8]. Поверхности кристалла портландита (см. рис. 3) можно разделить на два типа: базальные поверхности в направлении (001) и призматические поверхности в направлении, перпендикулярном базальным поверхностям. Приповерхностные слои всех базальных поверхностей (верхних и нижних) состоят из ОН-групп и химически идентичны. На границе приповерхностных слоев всех призматических поверхностей с окружающей средой находятся ОН-группы и ионы кальция; эти слои также идентичны химически. Таким образом, для изучения можно выбрать одну базальную и одну призматическую поверхность. Модельные поверхности были выбраны так, чтобы имитировать воздействие окружающей среды на 4 × 4 поверхностные группы (ОН– для базальных поверхностей и Ca(OH)2 — для призматических).
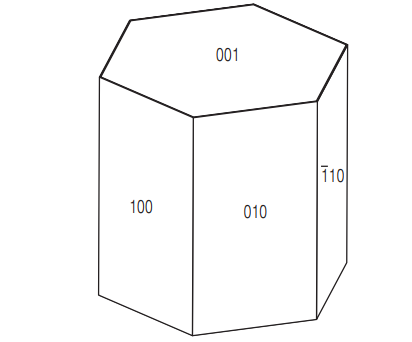
Рис. 3. Поверхности кристалла портландита
Чтобы избежать появления некорректных результатов, применили теорию DFT. Минимальная поверхностная энергия для реагентов, промежуточных соединений и продуктов была достигнута путем оптимизации геометрических параметров расположения атомов и переходных состояний; пути превращений определили, используя вычисления методом упругой ленты (Nudged Elastic Band, NEB). Подробное описание набора заданных значений величин для компьютерных исследований приведено в работах [9, 10].
3. Результаты и их обсуждение
В результате исследований методом DFT выявлены различия между двумя типами поверхностей и показано, что их можно понять в свете более благоприятного образования водородных связей. Стало очевидным, что вода увеличивает реакционную способность поверхности. Для этого достаточно четырех молекул H2O на одну молекулу СО2, что при атмосферной концентрации СО2 соответствует относительной влажности приблизительно 7,5 %. В таких условиях имеет место поверхностная реакция и не требуется растворение ионов. Четыре молекулы воды адсорбируются на поверхности, образуя монослой, способствующий эффективному переносу СО2. Дополнительная информация о механизмах реакции приведена в публикациях [9, 10].
Поскольку большинство исследований по карбонизации Са(ОН)2 выполнено при относительной влажности более 50 %, авторы решили исследовать, что происходит при более низкой влажности, и выяснить, когда происходит переход от «сквозьрастворного» механизма реакции к механизму реакции на поверхности.
Для начального тестирования реактора карбонизации была установлена относительная влажность газовой среды, равная 40 %. Возможна и более низкая влажность, но превращение гидроксида кальция в карбонат в условиях более низкой влажности заняло бы больше времени. На момент публикации статьи были закончены только первоначальные испытания. Эксперименты с более низкой влажностью выполняются в настоящее время. Когда было определено содержание карбоната в порошке и установлено присутствие карбоната на поверхности кристалла, стало понятнее, каким должно быть количество карбоната, необходимого для создания зародыша размером по крайней мере 100 нм.
На рис. 4 приведена зависимость содержания карбоната в порошке Са(ОН)2 от времени по данным метода рентгеновской дифракции (по Ритвельду). Поскольку это результаты первичных однократных опытов, статистическую оценку погрешности эксперимента выполнить пока невозможно. Дальнейшие исследования дадут информацию о погрешности, а также о влиянии на карбонизацию очень низкой влажности газовой среды (10—20 %).
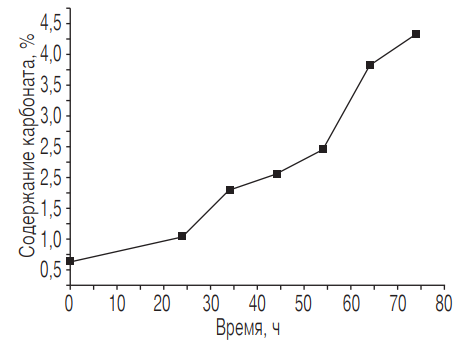
Рис. 4. Содержание карбоната в порошке Са(ОН)2 в зависимости от времени, определенное с использованием метода рентгеновской дифракции (по Ритвельду)
В случае порошка наблюдается непрерывный рост карбонизации (см. рис. 4). В начальный период (34 ч) карбонизация растет экспоненциально, затем замедляется; второй период экспоненциального роста начинается через 44 ч, и в возрасте 64 ч опять наблюдается замедление. Возможно, такой характер кривой объясняется тем, что вначале скорость реакции определяется химической кинетикой, уравнение которой, по всей видимости, имеет первый порядок. Это соответствует экспоненциальному поведению. Вода, образовавшаяся в ходе карбонизации, покрывает поверхность тонким слоем, в результате чего лимитирующей становится диффузионная стадия процесса. По мере того как растет толщина водного слоя, для диффузии требуется все большее время. Когда концентрация СО2 очень высокая (30 %), влага в основном расходуется на образование кластеров СО2 и воды (при относительной влажности 40 %). Кластеры достаточно стабильны и образуются во время смешивания газов. Это предотвращает конкуренцию между адсорбцией воды на кристалле и образованием кластера «СО2—вода». До тех пор пока слой воды не достигнет определенной толщины (составляющей примерно 4—7 монослоев), скорость реакции по-прежнему лимитируется диффузией. Данный период заканчивается, когда достигается критическая толщина водного слоя, и в нем начинают появляться ионы. Это вызывает дальнейший экспоненциальный рост скорости реакции, идущей теперь «через раствор». Поскольку слой пока еще тонкий, скорость процесса в растворе определяется скоростью химического взаимодействия. Так как по-прежнему в результате этого взаимодействия образуется вода в соответствии с суммарной реакцией Ca(OH)2 + CO2 → CaCO3 + H2O, водный слой продолжает расти, и спустя примерно 64 ч лимитирующая роль вновь переходит к диффузии.
Образование карбонатов авторы наблюдали при помощи электронной микроскопии. После карбонизации образца в течение 54 ч на его поверхности были обнаружены первые признаки изменений, которые показаны на рис. 5 и 6. На рис. 5 можно видеть кристаллиты, которые образовались на призматической поверхности (100). Кроме того, наблюдались образования-шарики на дефектах. Эти образования, по всей видимости, также состоят из карбонатов, на что указывают данные энерго-дисперсионного анализа (рис. 7).

Рис. 5. Зародыш CaCO3 на поверхности (100) через 54 ч карбонизации.

Рис. 6. Шарики и трещины, наблюдаемые через 54 ч карбонизации образца на поверхности (100)
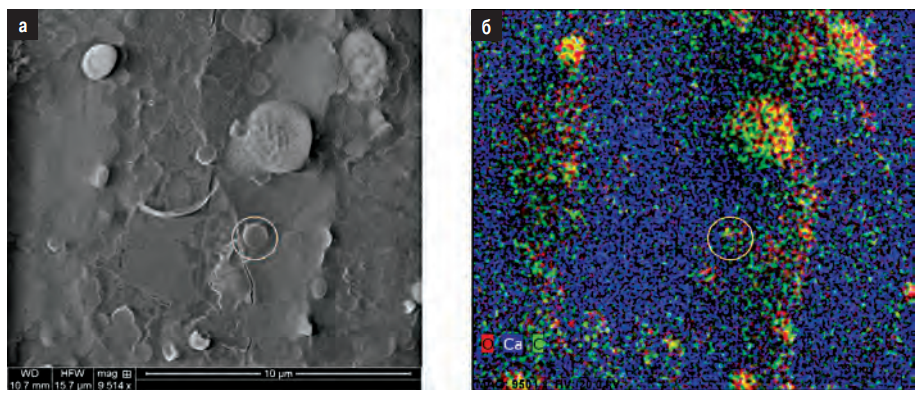
Рис. 7. Шарообразные структуры (а) и распределение в них элементов, полученное при помощи энерго-дисперсионного анализа (б). Видно, что шарики карбонизированы
На рис. 6 более детально видны мелкие шарики. Также видны трещины на поверхности, которые могут быть следствием механического напряжения из-за карбонизации на поверхности портландита. Вероятно, их появление обусловлено образованием карбоната на поверхности и высвобождением воды. В ходе реакции локальное количество воды становится настолько высоким, что она не может распределиться в виде слоя. В результате образуются нано- и микрокапли, в которых присутствуют гидроксид-ионы. Внутри этих капель тоже проходит карбонизация.
4. Выводы
Авторы исследовали карбонизацию гидроксида кальция в условиях низкой относительной влажности (40 %). Реактор карбонизации, оптимизированный для этих исследований, использовался для проведения экспериментов, которые сопровождались вычислениями при помощи метода DFT.
В течение первых 74 ч карбонизации дважды наблюдался переход от кинетического режима процесса к диффузионному. Такое поведение объяснено (в рамках DFT) очень низкой влажностью. Это позволило прийти к выводу, что первый цикл чередования химического и диффузионного режимов обусловлен реакциями на поверхности, тогда как второй — реакциями в растворе. Таким образом, завершение диффузионной стадии в первом цикле соответствует переходу реакции от «поверхностного» механизма к «сквозьрастворному».
Полученные результаты показывают, что карбонизация возможна даже в среде с низкой влажностью — сначала как реакция на поверхности, а затем как реакция в растворе. Это может иметь значение для разработки новых способов применения карбонизации при проектировании конструкционных материалов.
* Статья подготовлена авторами на основе доклада, сделанного на конференции 19.ibausil.
ЛИТЕРАТУРА
1. Shih S., Ho C., Song Y., et al. Kinetics of the reaction of Ca(OH)2 with CO2 at low temperature // Ind. Eng. Chem. Res. 1999. Vol. 38, N 4. P. 1316—1322.
2. Van Balen K. Carbonation reaction of lime, kinetics at ambient temperature // Cement and Concrete Res. 2005. Vol. 35, N 4. P. 647—657.
3. Beruto D.T., Botter R. Liquid-like H2O adsorption layers to catalyze the Ca(OH)2/CO2 solid–gas reaction and to form a non-protective solid product layer at 20 °C // J. European Ceram. Soc. 2000. Vol. 20, N 4. P. 497—503.
4. Moorehead D.R. Cementation by the carbonation of hydrated lime // Cement and Concrete Res. 1986. Vol. 16, N 5. P. 700—708.
5. Ruiz-Agudo E., Kudłacz K., Putnis C.V., et al. Dissolution and carbonation of Portlandite Ca(OH)2 single crystals // Environ. Sci. Technol. 2013. Vol. 47, N 19. P. 11342—11349.
6. Allen J.P., Marmier A., Parker S.C. atomistic simulation of surface selectivity on carbonate formation at calcium and magnesium oxide surfaces // J. Phys. Chem. C. 2012. Vol. 116, N 24. P. 13240—13251.
7. Allen J.P., Parker S.C., Price D.W. Atomistic simulation of the surface carbonation of calcium and magnesium oxide surfaces // J. Phys. Chem. C. 2009. Vol. 113, N 19. P. 8320—8328.
8. Nguyen M.T., Matus M.H., Jackson V.E., et al. Mechanism of the Hydration of Carbon Dioxide: Direct Participation of H2O versus Microsolvation // J. Phys. Chem. A. 2008. Vol. 112, N 41. P. 10386—10398.
9. Funk A., Trettin R. DFT study on the effect of water on the carbonation of portlandite // Ind. Eng. Chem. Res. 2013. Vol. 52, N 5. P. 2168—2173.
10. Funk A., Trettin R. (2015) Atomistic study of the mechanism of carbonation // Sobolev K., Shah S.P. (eds). Nanotechnology in Construction. Cham: Springer International Publishing. P. 293— 299.
| Автор: А. Функ, К.М. Салах Уддин, А. Ветцель, Б. Миддендорф |
| Рубрика: Наука и производство |
| Ключевые слова: карбонизация, портландит, кинетика, диффузия |




