Статьи
Синтез и гидратация трехкальциевого силиката
М. Костойя, Ш. Бишнои, Э. Галлуччи, К.Л. Скривенер,
Ecole Polytechnique Fédérale de Lausanne, Швейцария
Введение
В течение нескольких последних десятилетий для моделирования процесса формирования микроструктуры цементного камня были разработаны компьютерные модели с использованием различных подходов [1–5]. Модель µic (Майк), разработанная в нашей лаборатории, отличается тем, что она рассматривает сплошную среду, состоящую из дискретных частиц, а не из точечных элементов. В отличие от расчета гидратации целой системы, в данной модели развитие микроструктуры рассматривается на основе гидратации отдельных частиц.Уравнение Аврами [6], которое описывает кинетику процессов, связанных с нуклеацией и ростом новой фазы [7–10], адекватно моделирует поведение цемента на ранней стадии гидратации. То, что уравнение дает S-образную кривую, и тот факт, что раннюю стадию процесса гидратации цемента можно рассматривать как нуклеацию и рост, в целом оправдывает использование данного уравнения при моделировании кинетики процесса в начале процесса гидратации цемента.
Видоизмененная форма уравнения Аврами, применимая к кинетике гидратации C3S в начальный период, может быть записана следующим образом:
![]() (1)
(1)
где α– степень гидратации, t – время, k и n – постоянные, зависящие от материала и механизма реакции.
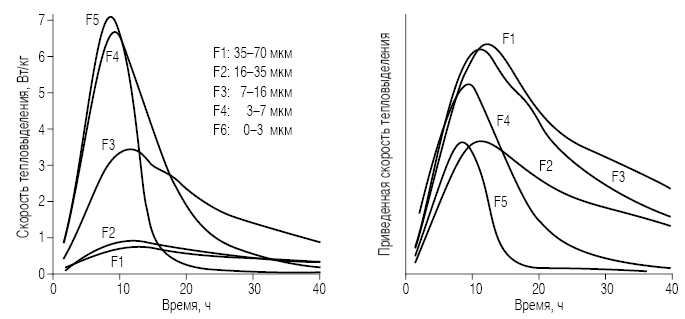
Рис. 1. а – скорость тепловыделения; б – скорость тепловыделения, приведенная к удельной поверхности частиц различных размеров [11]
В настоящей работе приведены результаты исследований в области синтеза алита и его разделения на отдельные фракции по размерам частиц. Представлены данные по кинетике гидратации, полученные методами изотермической калориметрии и измерения химической усадки. Наконец, здесь обсуждаются первые результаты применения уравнения Аврами для интерпретации калориметрических кривых для отдельных фракций.
Получение и свойства трехкальциевого силиката
Чистый триклинный C3S был приготовлен из смеси порошка высокочистого кварца и CaCO3 (оба материала фирмы Merck), взятых в стехиометрическом отношении 1:3. После гомогенизации в воде шлам сушили при 100° C, после чего из него прессовали таблетки размером 3,5 см. Затем таблетки обжигали при 1650°C в течение 5 ч и быстро охлаждали. Эту процедуру повторяли до тех пор, пока рентгеновский дифракционный анализ не показал отсутствие в материале свободного CaO (прибор фирмы Panalytical). Кристаллы C3S измельчали в течение 45 мин, а затем размалывали в тонкий порошок в течение 12 ч в шаровой мельнице.
Чистый C3S триклинной модификации (T1) был идентифицирован с помощью рентгено-дифракционного анализа [14]. Размер частиц порошка определялся с помощью гранулометрического анализа (прибор Mastersizer 2000, Malvern Instruments Inc.), а также микрофотографий (СЭМ) полированных шлифов. Кристаллы C3S по размерам сосредоточены в очень узком диапазоне около 6 мкм.
Следует отметить, что кристаллы зерен C3S спекаются в агломераты, что сильно затрудняет измельчение материала. Для того, чтобы раздробить эти агломераты, собственно, и потребовалось механическое измельчение в течение 45 мин с последующим домолом в шаровой мельнице в течение 12 ч.
Для получения более крупных кристаллов была разработана новая схема синтеза с введением ионов Al3+ и Mg2+. Алит готовили, смешивая карбонат кальция, высокочистый кварц, оксиды алюминия и магния. Для оценки влияния ионов Al3+ и Mg2+ на рост частиц, их размер и состав было приготовлено несколько комбинаций из компонентов (табл. 1). Добавление Al3+ и Mg2+ влияет на процессы нуклеации и роста зерна. Небольшие добавки ионов Al3+ увеличивают количество жидкой фазы, уменьшают вязкость смеси, обеспечивая таким образом более высокую степень диффузии химических соединений и способствуя росту более крупных зерен по сравнению с чистым C3S. Ион Mg2+ улучшает спекаемость смеси и способствует уменьшению количества свободной извести [15, 16, 17]. Схема синтеза алита с добавлением ионов Al3+ и Mg2+ не отличается от схемы получения чистого C3S, однако температура составляет 1500°C.
Таблица 1. Компоненты для синтеза алита, масс.%
| Состав, масс. % | С1 | С2 | С3 |
| SiO2 | 23 |
25 |
25 |
| CaO |
74 |
72 | 73 |
| Al2O3 |
2 |
1 |
0 |
| MgO | 1 | 2 | 2 |
На рис. 2 представлено влияние ионов Al3+ и Mg2+ на рост зерна алита. Составы C1 и C2, содержащие ион Al3+, отличаются более крупными частицами по сравнению с составом C3. На основании полученных результатов можно сделать вывод о том, что ион Al3+ играет основную роль в процессе роста зерен алита. Ион Al3+ увеличивает количество жидкой фазы, способствуя ускорению диффузии химических соединений и росту зерна [15]. Если ион Al3+ оказывает значительное воздействие на рост кристаллов алита, то ион Mg2+ снижает вязкость смеси, интенсифицируя массоперенос и уменьшая конечное содержание C3A в образцах [17]. Считается, что MgO является катализатором реакции растворения С3А в жидкой фазе; это затрудняет образование кристаллов C3A и способствует размещению иона Al3+ в решетке C3S [16]. При измельчении гранул в промежутках между циклами нагрева значительной разницы в размерах частиц обнаружено не было.
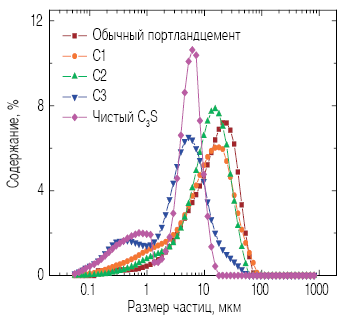
Рис. 2. Гранулометрический состав зерен алита с добавлением Al3+ и Mg2+
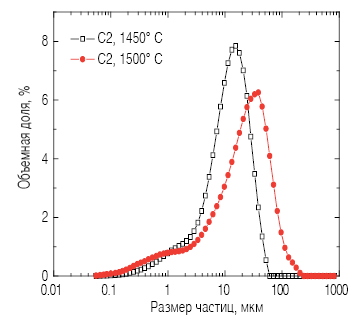
Рис. 3. Влияние температуры обжига на рост зерна

Рис. 4. Электронные микрофотографии синтезированного алита – C2 (а) и OПЦ (обычный портландцемент, б)
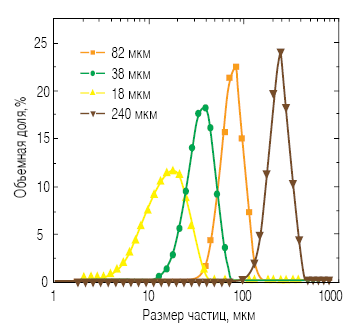
Рис. 5. Гранулометрические составы, использованные для исследований кинетики гидратации
Влияние размера частиц на кинетику гидратации
Влияние размера частиц алита на кинетику гидратации было исследовано с помощью изотермического калориметра (фирма TAM Air, Thermometric) при температуре 20,0 ± 0,1°C. Различные фракции материала затворяли водой при водоцементном отношении 0,4 и затем смесь помещали в калориметр для наблюдения за процессом гидратации с момента начала взаимодействия с водой.
Усадочные деформации контролировали методом дилатометрии согласно методике, разработанной в работе [19]. Для этого измеряли уменьшение объема цементного теста, регистрируя уровень в заполненной водой трубке, соединенной с алитовой пастой. В данной работе изменение уровня воды в трубке регистрировали с помощью фотоснимков, получаемых каждые 10 мин. Затем эти фотографии были обработаны с помощью специального программного обеспечения. Гранулометрический состав материала и водоцементное отношение оставались такими же, что и при изотермической калориметрии.
Результаты изотермической калориметрии (рис. 6, а) показывают более высокое тепловыделение для фракций, содержащих более мелкие частицы. Это можно объяснить тем, что более мелкие частицы гидратируются быстрее. Аналогичную тенденцию можно наблюдать и по результатам измерения химической усадки (рис. 6, б): более высокие скорости растворения и гидратации проявляются в виде более высокой скорости усадки.
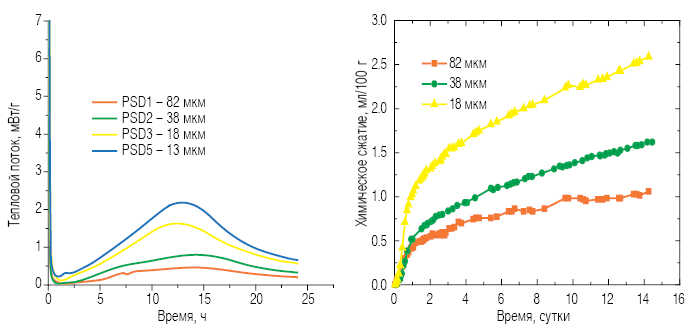
Рис. 6. Изотермические кривые калориметрии (а) и химическая усадка (б) образцов гидратированного алита различного гранулометрического состава
![]() (2)
(2)
Независимый исходный анализ каждой кривой показал, что значение n лежит близко к 2,0. В этом случае уравнение может быть записано так:
dα / dt = 2kt. (3)
Уравнение (3) может быть использовано для упрощенного анализа с целью получения оценочных значений k. Поскольку эта зависимость является линейной, то линейный участок кривых тепловыделения (рис. 7) был отдельно построен в виде функции от времени. Полученные значения k построены в зависимости от расчетных значений удельной поверхности измельченных материалов (рис. 8). Удельная поверхность была рассчитана в предположении, что смесь состоит из сферических частиц, размеры которых соответствуют распределению частиц фракций. Из рис. 8 видно, что параметр k имеет линейную зависимость от удельной поверхности. При первых попытках применить уравнение для описания экспериментальных данных было выяснено, что эта процедура не особенно чувствительна к величине n около 2,0. Это могло бы объяснить расхождение величин n в диапазоне от 1,5 до 3,0, встречаемое в литературе.
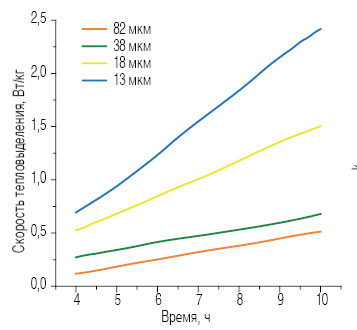
Рис. 7. Изотермические кривые калориметрии при гидратации отсеянных фракций алита
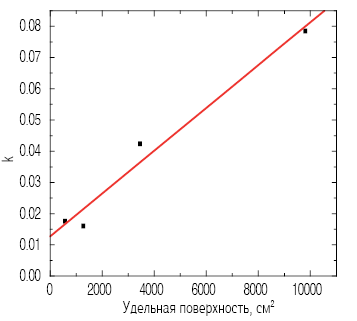
Рис. 8. Скорость, постоянная в зависимости от удельной поверхности, для различных фракций алита
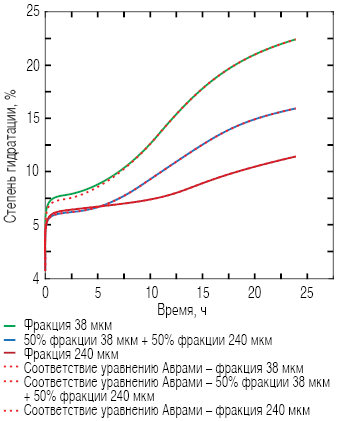
Рис. 9. Соответствие уравнению Аврами для несмежных фракций
Рис. 10. Зависимость среднего значения степени гидратации для двух несмежных фракций от степени гидратации их смеси в соотношении 50:50
Заключение
Разработана методика синтеза алита с учетом роли ионов Al3+ и Mg2+. Ион Al3+ играет значительную роль в процессе роста зерен трехкальциевого силиката, а ион Mg2+ улучшает спекаемость смеси, уменьшая содержание свободной извести.
Полученный алит был успешно разделен на различные фракции с помощью рассева и декантации. Процесс гидратации этих отдельных фракций изучался с использованием изотермической калориметрии и методом измерения химической усадки.
Обнаружено, что скорость реакции гидратации выше для материалов с более высокой удельной поверхностью. Скорость тепловыделения описана при помощи уравнения Аврами, причем наблюдалось преобладание линейной зависимости между константой скорости и удельной поверхностью.
Установлено, что процесс гидратации полифракционной системы может быть смоделирован через линейное сложение размеров отдельных частиц.
Благодарность
Авторы выражают благодарность Национальному научному фонду Швейцарии за финансовую поддержку.
Литература
1. Bentz D.P. Three-dimensional computer simulation of cement hydration and microstructure development // J. Am. Ceram. Soc. 1997. Vol. 80. No. 1. P. 3–21.
2. Garboczi E.J., Bentz D.P. The effect of statistical fluctuation, finite size error, and digital resolution on the phase percolation and transport properties of the NIST cement hydration model // Cem. Concr. Res. 2001. Vol. 31. No. 10. P. 1501–1514.
3. Navi P., Pignat Ch. Three-dimensional characterisation of the pore structure of a simulated cement paste // Cem. Concr. Res. 1999. Vol. 29. No. 4. P. 507–514.
4. Navi P., Pignat Ch. Effects of cement size distribution of capillary pore structure of the simulated cement paste // Journal of Computational Materials Science. 1999. Vol. 16. No. 1–4. P. 285–293.
5. Pignat C., Navi P., Scrivener K. Simulation of cement paste microstructure: hydrations pore space characterisation and permeability determination // Materials and Structure. 2005. Vol. 38. No. 2. P. 459–466.
6. Avrami M. // Journal of chemical physics. 1939. Vol. 7. P. 1103–1112; 1940. Vol. 8. P. 212–224; 1941. Vol. 9. P. 177–184.
7. Tenoutasse N., De Donder A. // Silicates Industriels. 1970. Vol. 35. P. 301.
8. Bezjak A., Jelenic I. On the determination of rate constants for hydration processes in cement pastes // Cem. Concr. Res. 1980. Vol. 10. No. 4. P. 553–563.
9. Brown P.W., Pommersheim J., Frohnsdorff G. A kinetic model for the hydration of tricalcium silicate // Cem. Concr. Res. 1985. Vol. 15. No. 1. P. 35–41.
10. Tennis P.D., Jennings H.M. A model for two types of calcium silicate hydrate in the microstructure of Portland cement pastes // Cem. Concr. Res. 2000. Vol. 30. No. 6. P. 855–863.
11. Scrivener K.L. Development of microstructure during the hydration of Portland cement / Ph. D. Thesis. University of London. 1984.
12. Garrault S., Behr T., Nonat A. Formation of the C-S-H layer during early hydration of tricalcium silicate grains with different sizes // J. Phys. Chem. B. 2006. Vol. 110. P. 270–275.
13. Tenoutasse N., ibid., 1969.
14. H.F. Taylor. Cement chemistry. Tomas Helford, London. 1997.
15. N. Antón et al. Liquid phase sintering of CMC´s based on clinker Portland // J. of European Ceram. Society. 2001. Vol. 20. No. 12. P. 2215–2224.
16. Xiaocum Liu, Yanjun Li. Influence of MgO on the formation of Ca3SiO5 and 3CaO·3Al2O3·CaSO4 minerals in alite-sulphoaluminate cement // Cem. Concr. Res. 2002. Vol. 32. No. 7. P. 1125–1129.
17. X. Liu et al. Effect of MgO on the composition and properties of alite-sulphoaluminate cement // Cem. Concr. Res. 2005. Vol. 35. No. 9. P. 1685–1687.
18. M. Courtial, M.–N. de Noirfontaine, F. Dunstetter, G. Gasecki, M. Signes-Frehel. Polymorphism of tricalcium silicate in Portland cement: A fast visual identification of structure and superstructure // Powder Diffr. 2003. Vol. 18. No. 1. P. 7–15.
19. M. Geiker. Studies of Portland cement hydration: measurements of chemical shrinkage and a systematic evaluation of hydration curves by means of the dispersion model. Ph. D. Thesis. Technical University of Denmark. 1983.




